Hronična limfocitna leukemija (HLL) je najčešći tip hematoloških maligniteta kod odraslih, ali najveći broj novodijagnostikovanih pacijenata sa HLL za nju nikada ranije nisu čuli. Iako reč ‘leukemija’ može da zvuči šokantno mnogim ljudima, HLL ima heterogeni i raznoliki klinički tok. U većini slučajeva HLL napreduje polako i prilično je pasivna bolest kod nekih bolesnika, tako da uopšte ne iziskuje terapiju celog života, dok je kod jednog manjeg broja pacijenata HLL bolest koju odlikuju agresivan tok i brzo napredovanje. Različiti aspekti HLL iziskuju i donekle različite terapijske pristupe, ali zahvaljujući širenju naših znanja o genskoj osnovi i kliničkom toku ove bolesti, danas su pacijentima sa agresivnijom bolešću dostupne nove i efikasne terapije.
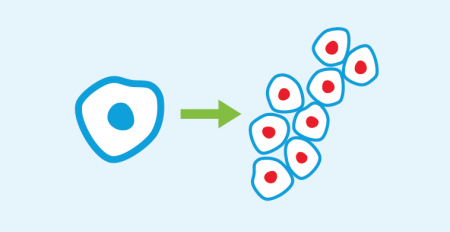
Leukemije su maligne bolesti krvi koje potiču iz belih krvnih zrnaca. Njih obično odlikuje abnormalno visok broj belih krvnih zrnaca u krvi (sam izraz ‘leukemija’ dolazi od grčkih reči ‘leukos’ i ‘haima’ koje znače ‘belo’ i ‘krv’). HLL je limfoidna leukemija, pogođene su bele krvne ćelije koje se zovu limfociti i koje se nagomilavaju (Slika 1.), dok reč ‘hronična’ opisuje njen spori klinički tok.
U grupi limfoidnih maligniteta HLL spada u tip B ćelijskih leukemija, koje potiču iz B limfocita. Ove ćelije pripadaju imunskom sistemu i odgovorne su za humoralni imunitet i kod zdravih osoba za imunitet posredovan antitelima. B limfocite normalno aktiviraju različiti patogeni (bakterije, virusi, gljivice, itd.) kada ti limfociti proizvode antitela koja se specifično vezuju za te patogene i obeležavaju ih; što omogućava drugim imunskim ćelijama da nađu i uspešno eliminišu patogene agense. Kod HLL normalna funkcija B limfocita je poremećena, pa leukemijske B ćelije podležu velikom broju nekontrolisanih ćelijskih deoba. Ova ekstenzivna proliferacija prvo ima za rezultat nagomilavanje leukemijskih ćelija u krvi, a onda sledi i njihova infiltracija u koštanu srž. Koštana srž je organ za hematopoezu (stvaranje ćelijskih komponenti krvi), i kako leukemijske ćelije ulaze u koštanu srž, onemogućava se normalna hematopoeza, pa se kao posledica razvijaju anemija i poremećaji krvarenja. Leukemijske ćelije mogu da budu prisutne i u sekundarnim limfatičkim organima kao što su limfni čvorovi i slezina, i da dovedu do njihovog povećanja. Veliki broj limfocita u krvi često je prvi i jedini znak HLL, a često ova bolest ne mora ni da se leči. Medjutim, ako bolest pokaže znake napredovanja ili ako se pojave novi simptomi, potrebno je intervenisati. (Slika 2.)
Hemioterapija je decenijama bila jedina i osnovna terapija za HLL, ali se danas ona kombinuje sa terapijom monoklonskim antitelima. Monoklonska antitela koja se koriste u terapiji HLL su slična antitelima koja proizvode B limfociti, ali umesto da obeležavaju patogene agense, ovi proteini se vezuju za molekule na površini leukemijskih ćelija.
Monoklonska antitela ili ‘mabs’ koja se koriste u terapiji HLL su specifična za jedan receptor koji se nalazi na B limfocitima, a zove se CD20, i njihovo vezivanje za ovaj receptor indukuje uništavanje leukemijskih ćelija. Danas, uz anti-CD20 monoklonska antitela, na raspolaganju su i druga monoklonska antitela koja se koristie u terapiji HLL. Kombinacija hemioterapije i monoklonskih antitela često se naziva imunohemioterapija i pokazala se efikasnom u većini slučajeva u kojima je potrebno lečenje.
Iako se kompletna supresija ili kompletna remisija HLL obično može postići hemioimunoterapijom, pacijenti sa agresivnom bolešću mogu da ne odgovore na ovu terapiju. To se dešava zbog pojave rezistencije koja antitumorsku terapiju čini neefikasnom ili zbog ponovne pojave HLL posle remisije, što se naziva relaps ili recidiv bolesti. Oba ova događaja baziraju se na klonskoj selekciji, što je u HLL opisano tek pre nekoliko godina; smatra se da je ova intenzivno proučavana pojava odgovorna za refraktornost/relaps bolesti. U većini slučajeva neuspeh konvencionalnih terapija za HLL može da se poveže sa poremećajima intracelularnog proteina pod imenom ‘TP53’. TP53 je poznat i kao ‘zaštitinik genoma’ jer je njegova uloga da održava ćelijsku genomsku stabilnost tako što otkriva prekide u genomu: ako TP53 prepozna poremećaj u DNK koji se ne može popraviti, on izaziva ćelijsku smrt. Konvencionalne hemioterapije se u mnogome oslanjaju na ovaj mehanizam jer izazivaju oštećenje DNK. Ove promene onda aktiviraju TP53, koji deluje preko različitih intracelularnih signalnih puteva i dovodi do ćelijske smrti. Poremećaji TP53 mogu da budu posledica genskih mutacija ili gubitka dela genoma (delecija) koji utiču na hromozom 17, na kome se nalazi gen TP53. Mutacija TP53 i delecija hromozoma 17 ima za posledicu oslabljenu funkciju proteina TP53. Nažalost, zbog visoke varijabilnosti leukemijskih ćelija, mali broj limfocita sa defektnim proteinom TP53 je prisutan u prvobitnoj populaciji ćelija HLL. Iako ponekad može da se nađe veoma mali broj leukemijskijh ćelija sa defektima TP53 proteina u krvii pre terapije HLL, hemioterapija deluje kao snažan pritisak na selekciju ovih ćelija, jer je verovatnije da će citotoksično dejstvo hemioterapije preživeti limfociti sa TP53 defektima, nego oni kod kojih to nije slučaj. Onda počinje intenzivna proliferacija ćelija sa TP53 mutacijama, pa kako se njihov broj i procenat u populaciji HLL ćelija povećava, bolest postaje rezistentna na terapiju i bolest se ponovo javlja (relaps). Ovaj proces u kome leukemijske ćelije stiču prednost u preživljavanju tako što dolazi do TP53 mutacije naziva se ‘klonska evolucija’. (Slika 3.)
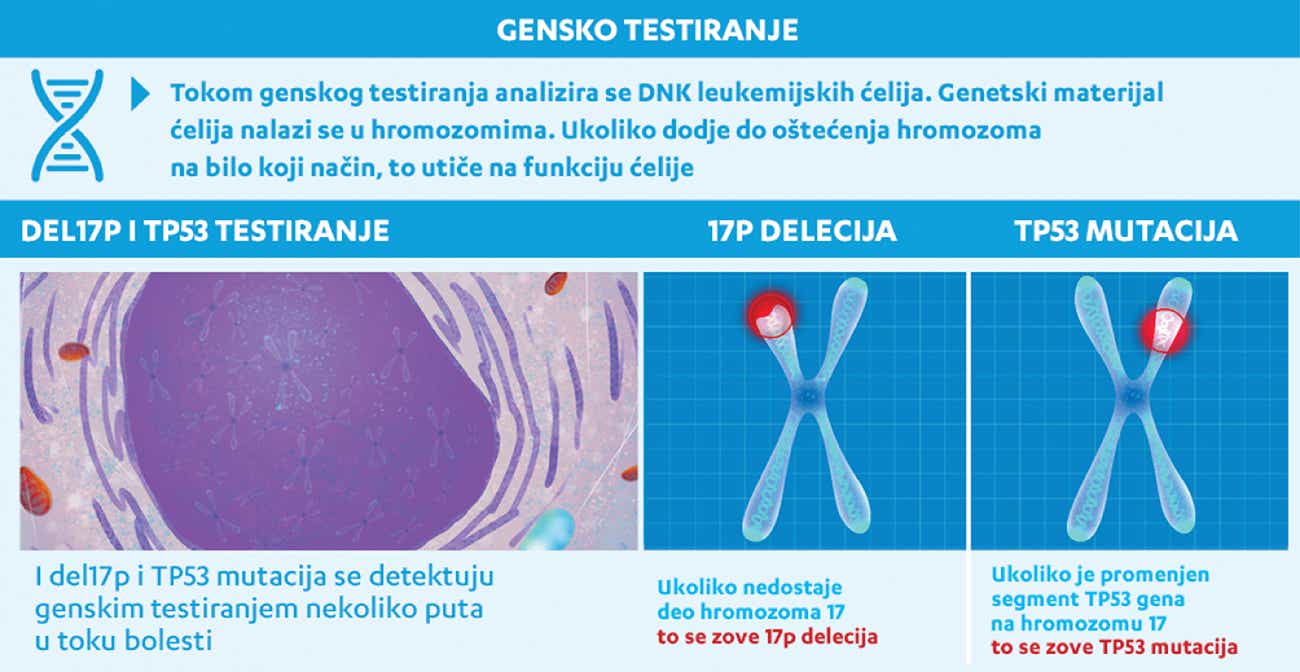
Značaj genskog testiranja se naglašava činjenicom da ako pre započinjanja lečenja HLL već postoji subklonska mutacija TP53 to ukazuje na neuspeh hemioterapije kod ove grupe pacijenata sa HLL. Međutim, to ne znači da će lečenje HLL biti potpuno neuspešno. Zahvaljujući intenzivnim istraživanjima na polju molekularne biologije i razvoju lekova proteklih godina, danas postoje ne samo prediktivni biomarkeri (kao što je TP53) za praćenje progresije bolesti, već i proteini na koje je moguće delovati ciljanim terapijama koje su na raspolaganju pacijentima sa refraktornom bolešću ili relapom. Brutonova tirozin kinaza (BTK) je jedna od najvažnijih meta u HLL za ciljano dejstvo lekova. BTK je intraćelijski protein koji igra ulogu u signalnim putevima B ćelijskih receptora tako što prosleđuje signale rasta i preživljavanja koji dolaze sa receptora na površini ćelija. Ti putevi se neprestano aktiviraju u ćelijama HLL, ali sada postoji alat kojim se prekida prenos signala ciljanjem na jednog od ključnih članova: BTK protein. Lekovi kojima je BTK meta nazivaju se inhibitorima BTK i njihovo uvođenje u terapiju predstavlja dotle neviđeno dostignuće u lečenju agresivne HLL. Inhibitori BTK su nekada bili na raspolaganju samo pacijentima kod kojih je dejstvo hemioterapije bilo bez uspeha, ali je sada moguća njihova primena u prvoj terapijskoj liniji i kod pacijenata sa visokorizičnom HLL i mutacijom TP53, jer se pretpostavlja da bi imali neadekvatan odgovor na standardnu hemioterapiju.
Zahvaljujući dubljem razumevanju biologije HLL koja su nam omogućila istraživanja na polju molekularne biologije, mi sada znamo da je indukovana ćelijska smrt ili apoptoza jedna od fundamentalnih sposobnosti ljudskih ćelija, a da je skoro uvek poremećena kod HLL. Neuspeh apoptoze remeti delikatnu ravnotežu ćelijske deobe i smrti kod limfocita, tako da ćelije počinju nekontrolisano da se dele (proliferišu) što dovodi do manifestacije leukemije. U ćelijama ljudi ključni molekul za regulisanje apoptoze je Bcl-2. Bcl-2 je jedan intraćelijski protein koji sprečava apoptozu i podstiče preživljavanje, a često je prekomerno aktiviran kod HLL. Indukovana smrt kod leukemijskih ćelija može da se podstakne ciljanom inhibicijom Bcl-2, što na kraju dovodi do remisije bolesti.
Kao što je pokazano u ovim primerima, savremene napredne terapije se široko primenjuju u uspešnoj borbi protiv malignih bolesti sa različitim genskim osnovama. Razvoj novih ciljanih terapija uključuje mnoge korake u rasponu od fundamentalnih istraživanja do kliničkih ispitivanja u kojima se proučava efikasnost lekova. Ove neprestane inovacije nude nove mogućnosti za pacijente kod kojih konvencionalne metode lečenja nisu bile uspešne. Iako se značaj ovog procesa ne može dovoljno naglasiti kod bilo koje vrste maligniteta, HLL je najčešći tip leukemija kod odraslih i pogađa milione ljudi širom sveta, a budući da se prvenstveno smatra bolešću starije životne dobi, očekuje se i porast incidence u narednim godinama. HLL ne samo da menja živote velikog broja pacijenata, već i njihovih porodica i srodnika; smatra se da svaki novi dijagnostikovani slučaj u proseku utiče na 5-10 ljudi. Imajući ovo u vidu, moguće je sagledati neprocenjivi pozitivni uticaj inovativnih terapija i sveobuhvatnog genskog testiranja. Tokom prethodnih nekoliko godina ciljane terapije su redefinisale HLL lečenje, ali čak i sa ovim impresivnim rezultatima i novim perspektivama za kontrolu HLL, ova bajka još ni izbliza nije završena.
Autori: Richard Kiss i Lili Kotmayer
Istraživačka grupa za molekularnu onkohematologiju, 1. odeljenje za patologiju i eksperimentalna istraživanja raka, Univerzitet Semelvajs (Semmelweis), Budimpešta, Mađarska
EM-118457; 12/2022


